臭氧基础知识
臭氧,一种有鱼腥气味淡蓝色气体。
臭氧自发现之初,随着人们对臭氧的认知不断提高,对臭氧的态度也曾经历过戏剧般的变化,那么就让我们一起来学习下关于臭氧的一些基础性质,看看有没有被刷新认知。
一、臭氧简介
臭氧或超氧,是无机分子,化学式 O3。一种淡蓝色的气体,带有明显的刺激性气味。它是氧的同素异形体,比双原子的同素异形体O2稳定差得多,在低层大气中分解为O2(氧气)。臭氧是通过紫外线(UV)和地球大气中的放电作用由氧气形成的。大气中约有90%的臭氧存在于离地面15到50公里之间的区域,也就是平流层,在平流层的较低层,即离地面20到30公里处,为臭氧浓度最高之区域,是为臭氧层。臭氧层吸收了太阳的大部分紫外线(UV)。
臭氧的气味让人联想到氯气,许多人甚至可以发觉到空气中浓度低至0.1 ppm的臭氧。臭氧的O3结构于1865年确定。该分子后来被证明具有弯曲结构并且是反磁性的。在标准条件下,臭氧是一种淡蓝色气体,在逐渐降低的低温下会冷凝成深蓝色液体,最后变成紫黑色固体。臭氧相对于更常见的双氧的不稳定性,使得高浓缩的臭氧气体和液态臭氧都可能在高温或快速升温至沸点的情况下爆炸性分解。因此,在商业上多以低浓度使用。
臭氧是一种强大的氧化剂(远远超过氧气),并具有许多与氧化有关的工业和消费应用。然而,同样高的氧化还原电位会导致臭氧破坏动物的粘液和呼吸组织,以及植物中的组织(超过约0.1 ppm的浓度),这使臭氧成为潜在的呼吸道危害物和接近地面的污染物。
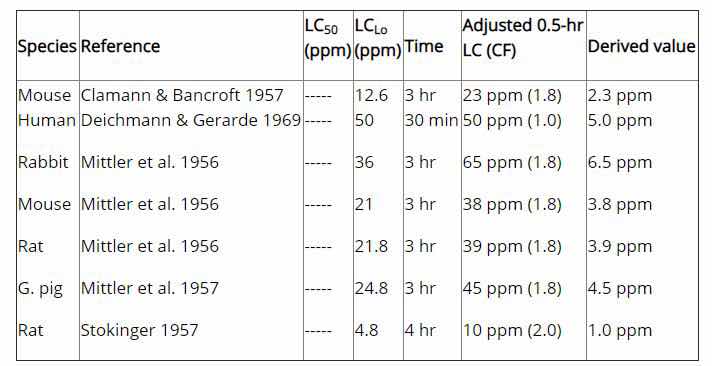
数据来源:美国国家职业安全与健康研究所
二、臭氧历史
1785年,荷兰化学家马丁努斯·范·马鲁姆(Martinus van Marum)进行了涉及水上电火花的实验,当时他发现一种不寻常的气味,他将这种气味归因于电反应,却没有意识到自己实际上已经产生了臭氧。

Christian Friedrich Schönbein
半个世纪后,克里斯蒂安·弗里德里希·尚贝恩(Christian Friedrich Schönbein)注意到了同样的刺激性气味,并把它识别为经常伴随闪电的气味。1839年,他成功地分离出气态化学物质并将其命名为“臭氧”,源于希腊语ozein意思是“嗅”。由于这个原因,通常将臭氧的发现归于克里斯蒂安·弗里德里希·尚贝恩。直到1865年,雅克·路易斯·索雷特才确定了臭氧的化学式O3,1867年肖恩·贝因证实了这一公式。
在19世纪下半叶的大部分时间直到20世纪,臭氧被自然主义者和健康追求者视为环境中的健康成分,并会在明信片和商会抬头显示,加利福尼亚州博蒙特市的正式口号是“博蒙特:臭氧区”。在户外工作的博物学家通常认为较高的海拔高度是有益的,因为它们的臭氧含量较高。在夏威夷工作的博物学家亨利·亨肖(Henry Henshaw)写道:“ [海拔较高]的大气层完全不同,其中的臭氧足以维持必要的能量[工作]” 。海边的空气被认为是健康的,因为它含有臭氧。但是产生这种联想的气味实际上是卤化海藻代谢产物的气味。
臭氧的大部分吸引力似乎源于其“新鲜”的气味,这种气味唤起了净化性能的关联。但是科学家指出了其有害作用。1873年,詹姆斯·杜瓦(James Dewar)和约翰·格雷·麦肯德里克(John Gray McKendrick)记录了青蛙变得迟钝,鸟类呼气,兔子的血液在暴露于“臭氧化空气”后表现出降低的氧气含量,这“具有破坏性作用”。克里斯蒂安·弗里德里希·尚贝恩本人报告说,吸入臭氧会导致胸痛,粘膜刺激和呼吸困难,并且小型哺乳动物死亡。
1911年,伦纳德·希尔和马丁·弗莱克在《英国皇家学会学报B》上发表文章称,“臭氧的有益健康作用,经过反复反复宣传,已成为普遍信念的一部分,然而迄今为止,支持其良好效果的确切的生理学证据几乎是完全缺乏的。关于臭氧的生理作用的唯一经过充分确定的认知是,臭氧会引起肺部刺激和“水肿”,如果在任何时候以相对较高的浓度吸入,都会导致死亡。”
第一次世界大战期间,臭氧已在伦敦的亚历山德拉王后军队医院进行了测试,可作为伤口消毒剂。将气体直接施加到伤口长达15分钟,这导致对细菌细胞和人体组织的损害。最后发现其他消毒技术,用防腐剂冲洗伤口是更优的选择,因此放弃了用臭氧消毒的方法。
三、臭氧的物理性质与结构
臭氧是一种无色或淡蓝色气体(液化时为蓝色),微溶于水,而在惰性非极性溶剂(如四氯化碳或碳氟化合物)中的溶解度更高,在其中形成蓝色溶液。在161 K(-112°C; -170°F)下,它凝结形成深蓝色液体。让这种液体升温到沸点是危险的,因为高浓度的气态臭氧和液态臭氧都能引爆。在低于80 K(−193.2°C; −315.7°F)的温度下,会形成紫黑色固体。
大多数人可以在空气中察觉到约0.01μmol/ mol的臭氧,它有一种非常特殊的尖锐气味,有点像氯漂白剂。暴露于0.1至1μmol/ mol会引起头痛,灼热的眼睛和对呼吸道的刺激。即使空气中的臭氧浓度很低,也会对有机材料(如乳胶,塑料和动物肺组织)造成破坏。
臭氧是反磁性的,它的所有电子都是成对的。相反,O2是顺磁性的,包含两个不成对的电子。
臭氧光谱
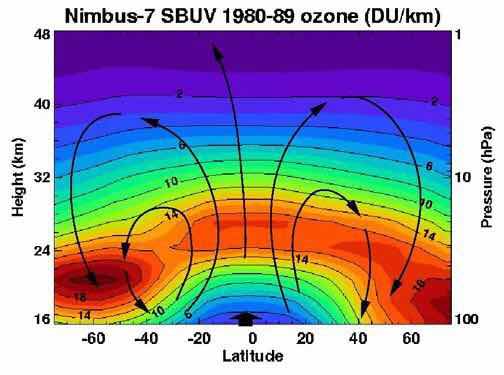
Nimbus-7卫星测得的臭氧浓度
根据微波光谱的实验证据,臭氧是弯曲分子,具有C 2v 对称性(类似于水分子)。在○ - ○距离为127.2 pm (1.272 Å)。O – O – O角为116.78°。中心原子是SP ²具有一对孤对杂交。臭氧是一种偶极矩为0.53 D的极性分子。该分子可以表示为具有两个贡献结构的共振杂合体,每个结构的一侧均具有单键,而双键具有在另一,该结构在两侧的总粘结顺序为1.5,它与亚硝酸根阴离子是等电子的。
臭氧是具有三种振动模式的弯曲三原子分子:对称拉伸(1103.157 cm -1),弯曲(701.42 cm -1)和反对称拉伸(1042.096 cm -1)。对称的拉伸和弯曲是较弱的吸收体,但反对称的拉伸却很强,并导致臭氧是一种重要的次要温室气体。尽管基于紫外线的测量更为常见,但该红外波段也用于检测环境和大气臭氧。
四、臭氧的反应
臭氧是已知最强大的氧化剂之一,它的氧化性远比O2强。在高浓度下它也是不稳定的,会分解成普通的氧气。它的半衰期随大气条件(例如温度,湿度和空气流动)而变化。在带有风扇的密封室中,该风扇可移动气体,在室温下,臭氧的半衰期约为一天。一些未经证实的主张断言,臭氧在大气条件下的半衰期可短至三十分钟。
与金属
臭氧会将大多数金属(金,铂和铱除外)氧化为处于最高氧化态的金属氧化物。例如:
Cu +O3→ CuO +O2
含氮和碳的化合物
臭氧还将一氧化氮氧化成二氧化氮:
NO + O3→ NO2+ O2
该反应伴有化学发光。该NO2可以被进一步氧化:
NO2 + O3 → NO3 + O2
该NO3形成能与NO2反应形成N2O5
固体高氯酸氮可由NO2,CLO2和O3制成:
NO2+ ClO2+ 2 O3 → NO2ClO4+ 2O2
臭氧即使在室温下也会与碳反应形成二氧化碳:
C + 2O3→ CO2+ 2O2
含硫化合物
硫酸可以由臭氧,水和元素硫或二氧化硫产生:
S + H2O +O3→H 2SO4
3 SO2 + 3H2O +O3→3H 2SO4
在气相中,臭氧与硫化氢反应生成二氧化硫:
H2S +O3→SO2+H2O
但是在水溶液中,会发生两个相互竞争的同时反应,一个反应生成元素硫,另一个生成硫酸:
H2S+ O3→S +O2+H2O
3H2S + 4O3→3 H2SO4
与烯烃和炔烃
烯烃可以在称为臭氧分解的过程中被臭氧氧化裂解,从而产生醇,醛,酮和羧酸,具体取决于后处理的第二步。
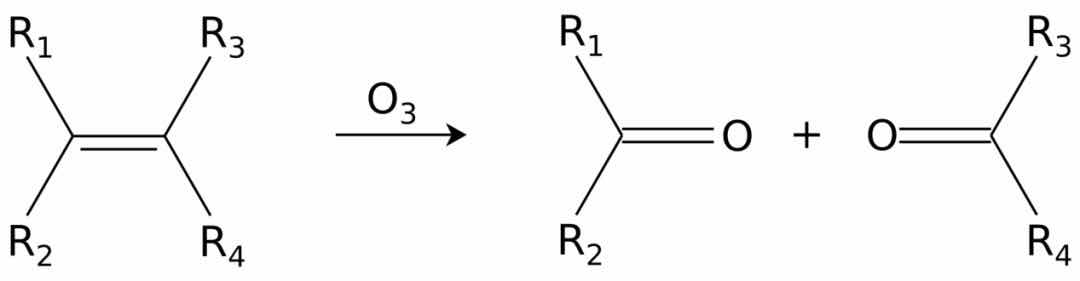
臭氧也可以裂解炔烃以形成酸酐或二酮产物。如果反应在水的存在下进行,则酸酐水解,得到两种羧酸。
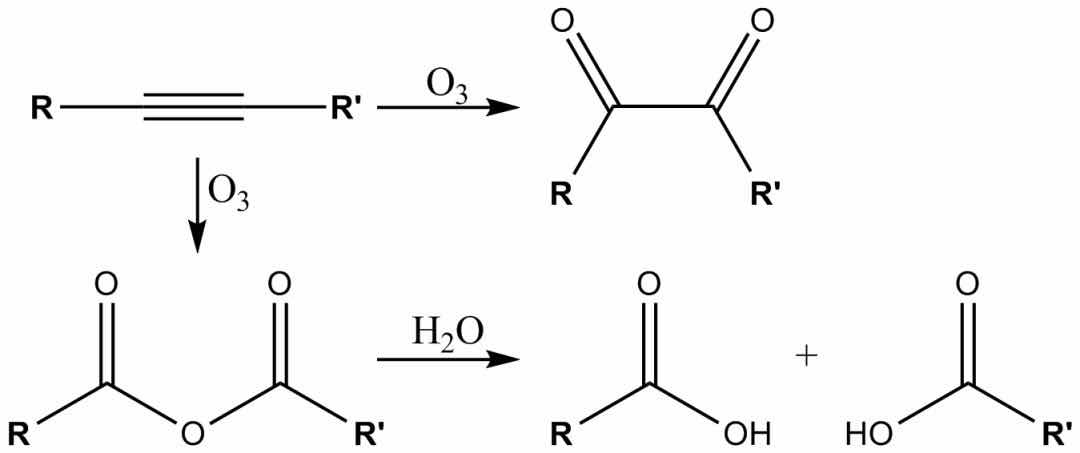
通常,臭氧分解是在二氯甲烷溶液中于-78°C的温度下进行的。经过一系列裂解和重排后,形成了有机臭氧化物。通过还原后处理(例如,乙酸中的锌或二甲基硫醚中的锌),将形成酮和醛,而通过氧化后处理(例如,含水或醇性过氧化氢),将形成羧酸。
